こんにちは。
今回のワルダー法というのは、水酸化ナトリウムと炭酸ナトリウムの混合溶液の滴定の方法の名称で、これ以外にもウィンクラー法という滴定方法があります。
このワルダー法ははっきり言って、受験化学の中和滴定最難関です。
逆滴定の中で一番難しいのがこいつです。この記事を読む前に少なくとも逆滴定ってなんなのか?ってことは確実にマスターしておいてください。
また、試験にもよく出るのでこのワルダー法による二酸化炭素の逆滴定は必ずできるようになってください!
目次
ワルダー法のどこが二酸化炭素の逆滴定?
ワルダー法っていうのは、水酸化ナトリウムと炭酸ナトリウムの混合溶液を滴定する方法だと言いました。
って思っても無理ないでしょう。なので順をおって確認していきましょう。
逆滴定って気体のモルを測るためのものでしたね!(厳密にいうと難溶性の物質ならなんでも)二酸化炭素って水に100%溶けません。
だから中和で塩にして溶かします。

このときNaOHはCO2よりも過剰に入れます。もし二酸化炭素を過不足なく中和する量しかなかったら絶対に反応しきることはできません。相手は気体ですからね。
2NaOH+CO2→Na2CO3+H2O
ってなります。NaOH:CO2=2:1で反応します。なので、

この線分図めっちゃ大事なんで覚えといてくださいね!あと二酸化炭素は1molだったらNaOHは2mol消費されることも気をつけてください!こういうややこしいところをまとめて考える方法もあとで教えますので!

こういう状況になりますよね。過剰な水酸化ナトリウムに二酸化炭素が加わったとします。すると、この溶液ってどうですか?
「NaOH+Na2CO3の混合溶液」になってませんか?そう、逆滴定の中にこのワルダー法が入り込んでいるんです。なので、このワルダー法を説明することは二酸化炭素の逆滴定の説明に直結するんです!
今から説明の仕方を説明しますね!今から全く同じ現象を3つの視点から説明します。でもこの3つは対応していることを考えながら、読んでください。
・ワルダー法ではどういう反応が起こっているのか(反応の流れ)
・ワルダー法の滴定曲線
・ワルダー法のモル関係を表した線分図
ワルダー法の反応の流れ
この溶液をHClで滴定していくわけですが、HClが滴定する相手はNaOHのOH–(強塩基)とNa2CO3の1つ目(弱塩基)と2つ目(もっと弱塩基)の3つがあります。

強塩基の水酸化ナトリウムが電離したOHーから炭酸ナトリウムまで順番にH+を受け取る(ブレンステッド則的)中和反応をしていきます。
ちなみに、二段滴定のことを思い出して欲しいのですが、二段滴定の炭酸第1電離と第2電離では明確に電離定数の差がありました。
電離定数とは電離のしやすさで、電離しやすいほど酸性として、塩基性として強いことを表します。つまり、電離定数の差が大きいほど、反応する順番が明確になっているんです。
これは、弱酸でさらに電離定数が104以上の差があるからでした。だから炭酸ナトリウムの1つ目の受取手と2つ目の受取手は、兄と弟に例えていました。

お兄ちゃんが受け取り終えてからじゃないと弟は、H+を受け取らせてくれないのです。
一方で、お兄ちゃんはそれよりも強塩基の先輩の水酸化ナトリウムがH+を受け取っているところに割り込んでH+を受け取り始めます。

OH-の中和が完了する前に炭酸ナトリウムの第一中和は始まります。そしてこの二人が終わった後に、やっと弟がH+を受け取り始めるのです。
じゃあ、この反応の流れを頭に入れたら、次はこの反応が滴定曲線になるとどうなるかをみていきましょう。
逆滴定の滴定曲線はこうなる!
逆滴定の滴定曲線は必ずかけるようにしてください。このワルダー法の逆滴定を考える上で、この滴定曲線が自分でかけるようにしておくだけで問題文が何を表しているか一瞬でわかるようになります。
まず、炭酸ナトリウムの二段滴定は第1中和と第2中和では電離定数に大きな差があります。
だから、二段滴定のようにpHジャンプ(指示薬で変色を確認することができるほど一気にpHが変わること)がはっきり2箇所で確認できるんです。
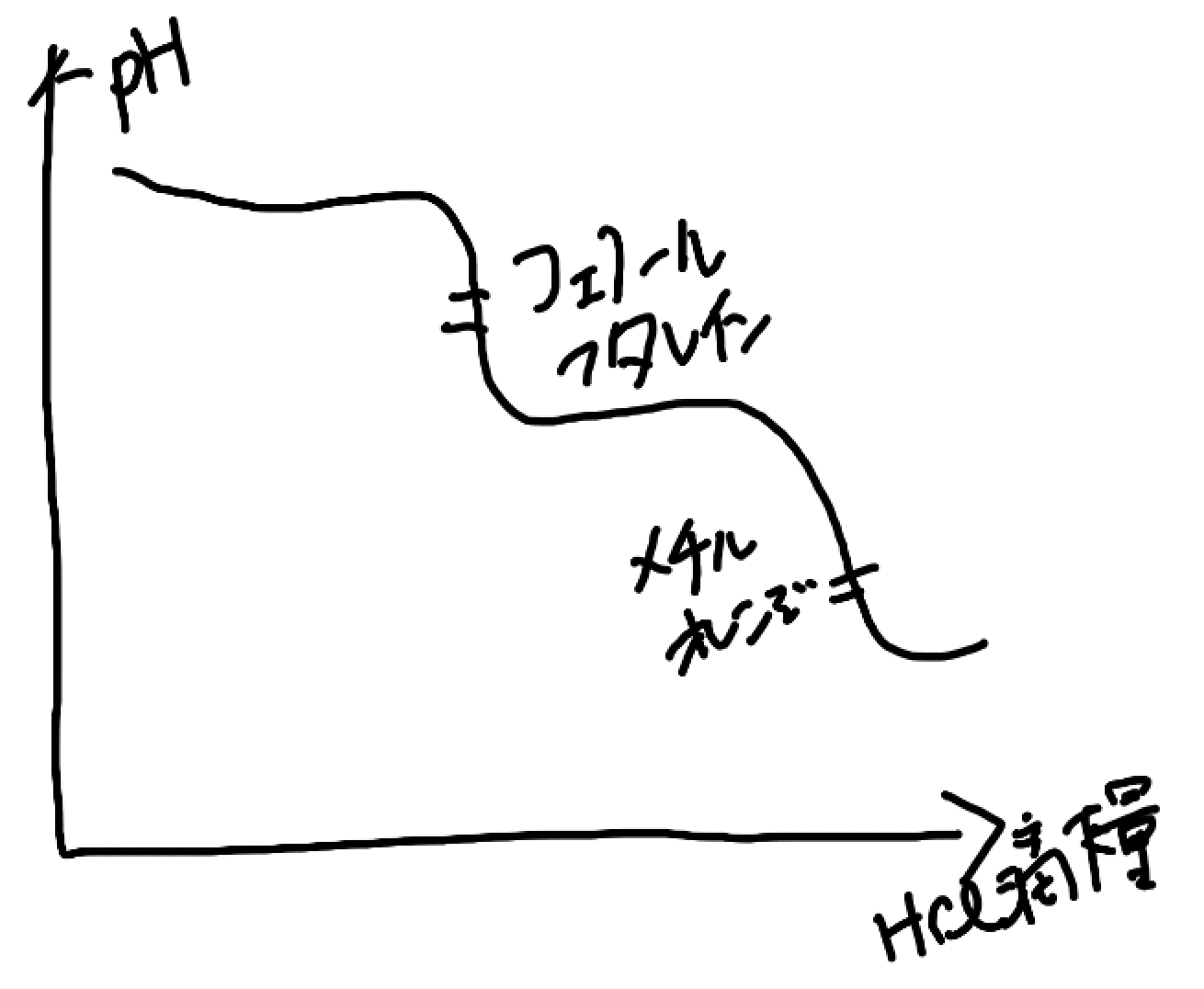
でも、今回NaOH+Na2CO3では話が変わります。さっきも言いましたが、炭酸ナトリウムの第1中和が、水酸化ナトリウムの中和に割り込みます。これが滴定曲線にも現れるんですよ。
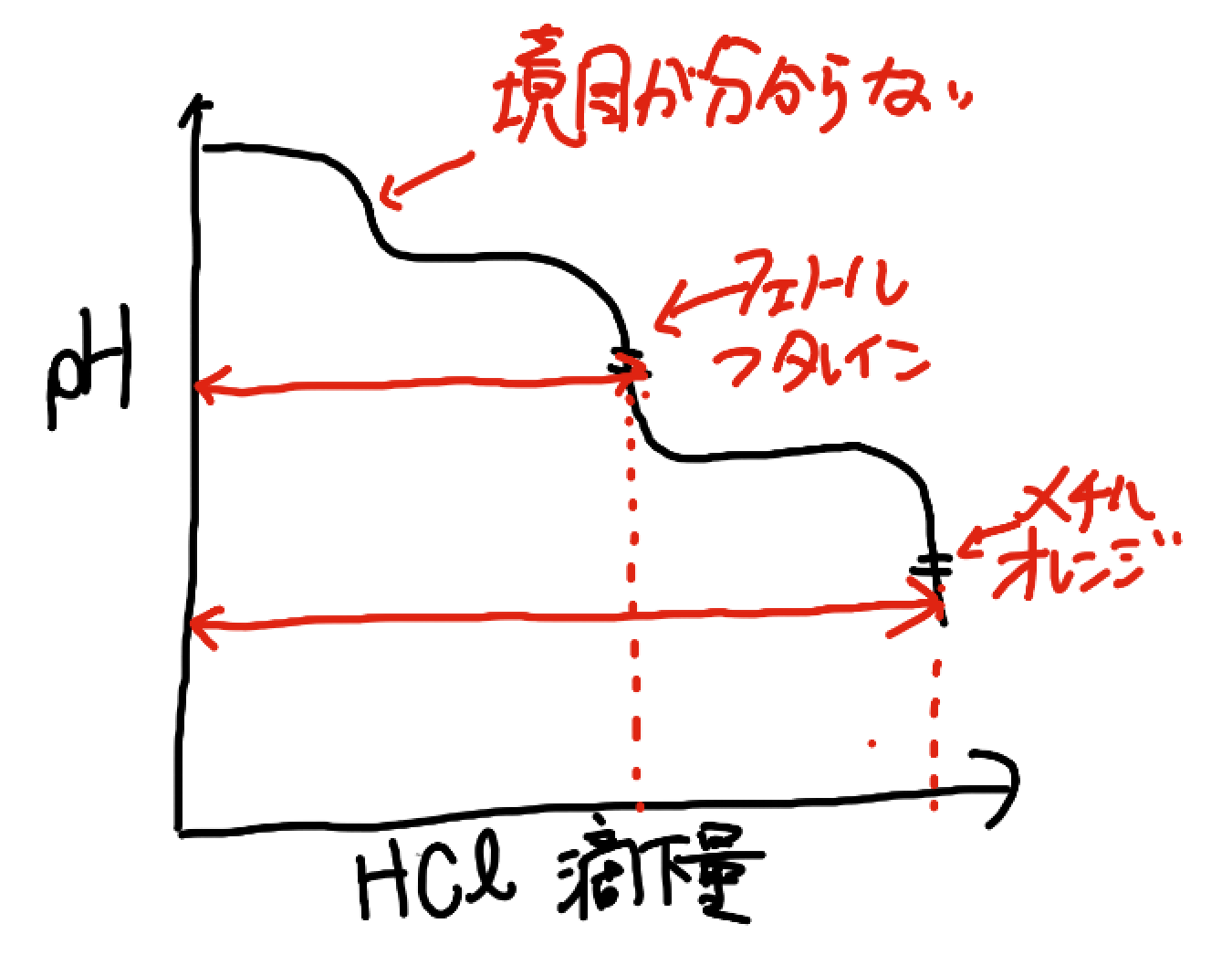
NaOHと炭酸ナトリウムの第1中和は、pHジャンプが起こりません。つまり、NaOHを中和するのに必要だったHClの滴下量は指示役ではわからないんですよ!!
もし、問題でNaOHは何molだったのかって聞かれたらどうするかわかりますか。わかっているのは、メチルオレンジ、フェノールフタレインが変色するのに必要だったHClの滴下量 V1,V2とHClの濃度、NaOHの濃度です。
それは、図に表せば簡単にわかります。
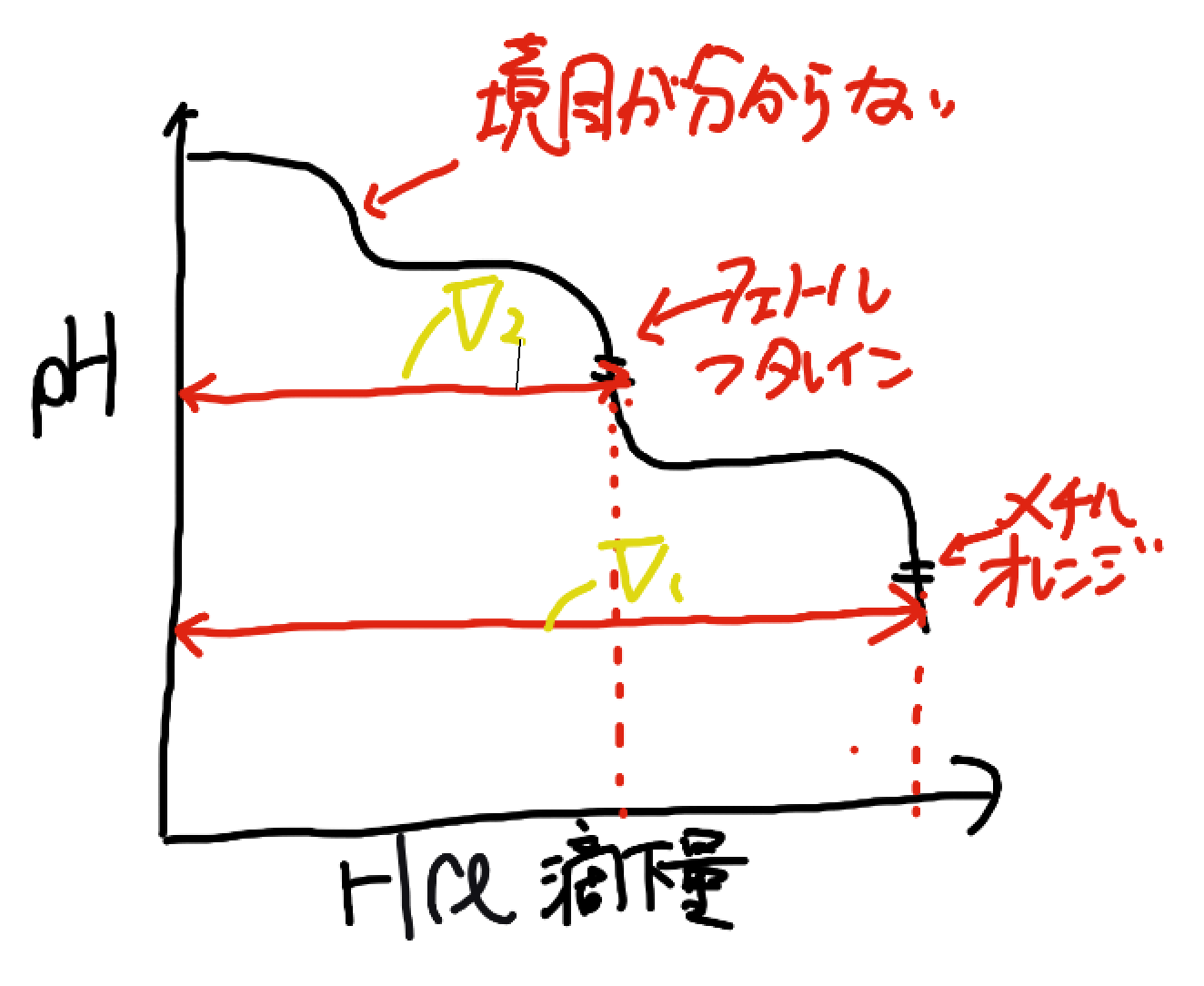
まず図にするとこうなりますね。この図でV1-V2は炭酸水素ナトリウムを滴定する時に必要なHClの滴下量ですよね。
そして
Na2CO3+HCl→NaCl+NaHCO3
NaHCO3+HCl→NaCl+H2CO3
この式を見たらわかるように、炭酸ナトリウムが炭酸水素ナトリウムにそのまま変わっているわけで、炭酸水素ナトリウムの量がわかれば、炭酸ナトリウムの量もわかるわけですよ。
炭酸水素ナトリウムを滴定するのに必要だったHClは炭酸ナトリウムを滴定するのに必要な量と同じです。

NaOHを滴定するのに必要なHClの滴下量をV3とすると

V3=V1-2(V1-V2)
このようになります。ちなみに、一番重要な二酸化炭素のモルの求め方は簡単です。炭酸水素ナトリウムを滴定するのに必要なHClのmolと全く同じです。
CO2のモル=Ca(V1-V2)
です。
二酸化炭素の逆滴定を線分図に表す
ラストです!この反応を線分図で表します。計算問題では、めちゃくちゃ重要です。でもこれって基本中の基本を忘れなければいいんですよ。
酸塩基の中和反応の計算問題はどういう式を立てればいいのか覚えていますか?
H+mol=OH–mol
ですよね。
これを線分図に表すだけなんです。
ステップ1水酸化ナトリウムに二酸化炭素を溶かす

まず過剰なNaOHに二酸化炭素を加えるところです。そうすると、二酸化炭素は
CO2+H2O→H2CO3
となって二価の酸となります。なので二酸化炭素のモルの2倍OH-は消費されるので上の図のようになります。
ステップ2HClでNaOH+Na2CO3の混合溶液を滴定しフェノールフタレインが変色するまで

これをHClで滴定します。先ほども言いましたが、NaOHの滴定終了ポイントはわかりません。炭酸ナトリウムの第1中和がNaOHがH+を受け取り終えるのを待たないからです。
なので、最初に指示薬が変色するのは、

ここです。NaOH+Na2CO3を中和した時です。
この時溶液で起こった反応は、
NaOH+HCl→NaCl+H2O
Na2CO3+HCl→NaHCO3+NaCl
になります。なので、溶液にはNaHCO3のみが残っている状態です。
ステップ3HClでNaHCO3を中和しメチルオレンジが変化するのを待つ
このようになります。
ところで、逆滴定の目的って覚えてますか?二酸化炭素のmolを求めることですよね。どうやって求めるか上の線分図をみてわかりますか?
上の図を書いたら明らかなんですが、「フェノールフタレインが変色してからメチルオレンジが変色するまでに必要なHClのモル」が二酸化炭素のモルなんです。
なので二酸化炭素のモルの求め方は、
ということになります。
ワルダー法のまとめ
ワルダー法による二酸化炭素の逆滴定の問題を解く方法は、
・どういう順番で反応するのか絵で理解する
・滴定曲線をどんな場合でも書けるようにする
・線分図でH+mol=OH–molを表現する。
この2つです!必ずマスターしてください。ここまで深く理解できている受験生はほとんどいないのでここはなんとか乗り切ってください!
















こんにちは。
質問なのですが、線分図で、フェノールフタレインが変化するのがNaOH+NaCO3が中和したところというのはわかったのですが、なぜそれがH2CO3由来のH+のブロック一つ分を過ぎたところなのかが理解できません。
教えていただけますでしょうか。
>なぜそれがH2CO3由来のH+のブロック一つ分を過ぎたところなのかが理解できません。
フェノールフタレインの色が変化するのがこのタイミングだからです!変色域をご確認してもらえるとわかるかなと。
なるほど!
CO32-がH+を受け取ることで一段目の中和が起き、その時に出来たNaHCO3が塩基性の塩であるために、水溶液が塩基性になり、その時の水溶液のpHがたまたまフェノールフタレインの変色域の範囲と被るから色が変化するのですね!
全て一から理解することができてスッキリしました。
お忙しい中、本当にありがとうございました。