こんにちは。
今日は、逆滴定の1つのパターンを解説しちゃいますよ!
逆滴定は実はこんな風に分類されます。まず、アンモニアか二酸化炭素かで2パターンあり、二酸化炭素の逆滴定でよく使われるのがこのウィンクラー法です。
| 気体 | 過剰溶液 | 滴定溶液 |
| アンモニア | HCl | NaOH |
| 二酸化炭素 | Ba(OH)2 | H2SO4 |
| 二酸化炭素 | NaOH | HCl(ウィンクラー法) |
| 二酸化炭素 | NaOH | HCl(ワルダー法) |
二酸化炭素の逆滴定のうちの1つの方法です。そんなに難しくないので普通についてきてください!
目次
NaOHと炭酸ナトリウムの滴定曲線をおさらいしよう!

このように2つのグラフがありますね。この2つのグラフを組み合わせるとこの

ちなみに、本来ワルダー法もウィンクラー法もNaOHとNa2CO3の混合溶液からNa2CO3のmolを求めるものなのです。でもね!
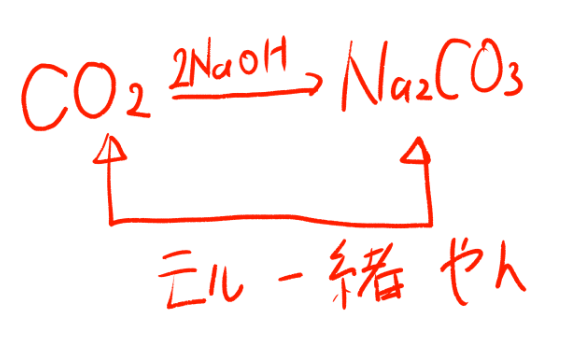
CO2+2NaOH→Na2CO3+H2O
という反応で炭酸ナトリウムが出来るんですから、炭酸ナトリウムのモルがわかっちゃえば、二酸化炭素のモルもわかりますよね!
ウィンクラー法の流れ
何度も言うけど、ウィンクラー法もワルダー法も両方共NaOH+Na2CO3を滴定する方法でそれを二酸化炭素の逆滴定に応用しているわけです。
いや、ちがうな、応用と言うか目的が同時に達成できてしまうんです。炭酸ナトリウムのモルを求めるってことは二酸化炭素のモル求めるのと同じやからね!
まずNaOH+Na2CO3の溶液が入った容器があります。この容器を2つに等量入れます。

そして片方ずつ滴定していきます。そして、等量いれたものにそれぞれメチルオレンジとBaCl2を入れます。

ウィンクラー法手順1:メチルオレンジを入れて溶液の中和滴定終了を
片方の容器にメチルオレンジを入れてHClで滴定します。メチルオレンジの指示薬の変色域は、下図のようになるよね?

NaOHとNa2CO3の両方が中和終了したときのHClの滴定量を測定できます!
ウィンクラー法手順2:BaCl2を加えてNaOHの滴定に必要なHClの量を測定する
水酸化ナトリウムと炭酸ナトリウムの溶液に塩化バリウムいれたら何が起こるかわかりますか?その化学反応式書けますか?イオン反応式は書けますか?
色々復習しておいてくださいね!
まず、こんな反応が起こります。
BaCl2+Na2CO3→BaCO3+2NaCl
そう!これは無機化学でやったけど、『沈殿反応』がおこるわけですよ!BaCO3こいつは沈殿する。
なので多めにBaCl2いれたら全部Na2CO3を落とすことが出来るって言う戦法なんですよ!そしたら溶液中に残るのは、『NaOH』のみですよね!
てことは、これを滴定したら、NaOHのみのモルがわかってしまうんですよ!
こんな感じです。ちなみにこの画像では、NaOHのモルがわかると書いていますが、実際にわかるのはNaOHを滴定するのに要した「HClのモル」です。でNaOHとHClは1:1で反応するのでHClのモルが分かれば、NaOHのモルもわかるって寸法です!
2つを合わせるとNa2CO3のモルがわかる
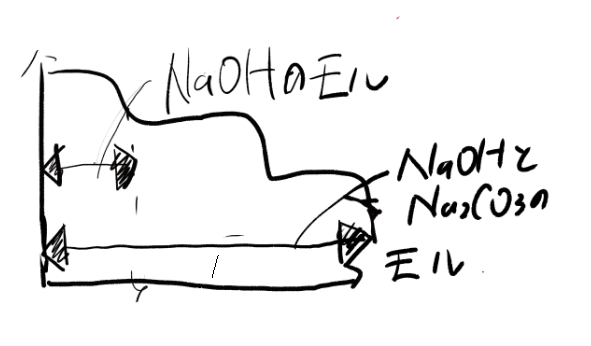
これまでにわかっている内容を←→で表してみました。どうかな?これで炭酸ナトリウムのモルがわかるんですよ。

こういう感じで引き算で赤いところが出せる。この赤いところを2でわれば、炭酸ナトリウムのモルが出てくるわけだ!
なんで2で割ったら出てくるか?炭酸ナトリウムは2価の塩基だからだ!
なんで二酸化炭素の逆滴定に使えるのか?
今回のウィンクラー法ってどこにも二酸化炭素なんて言葉が出てきていないよね?なんでこれが二酸化炭素の逆滴定に使えるのか疑問かもしれない。
NaOHとNa2CO3の混合溶液を滴定するやつやん!って思った人も多いかもしれない。でもさっしのいい人はわかっているかもしれない。
逆滴定というのは、過剰のNaOHにCO2をくぐらせて滴定するという技!なので結局NaOHとNa2CO3の混合溶液になるってわけだ!
ルーツをたどれば、この炭酸ナトリウムは二酸化炭素から出来てるわけだから、二酸化炭素のモルもわかるってわけですよ!ええ!
ウィンクラー法の例題
不純物としてNa2CO3を含むNaOHの結晶を水に溶かし100mLの溶液とした。この溶液20mLずつを別々の容器に取り、一方にはメチルオレンジを指示薬として1.0mol/Lの塩酸で滴定したところ、溶液が変色するまでに18.2mLを要した。
また、他方には、もはや白色沈殿が生じなくなるまでBaCl2水溶液を加えた後、フェノールフタレインを指示薬として加え、よく振り混ぜながら1.0mol/Lの塩酸で滴定したところ、溶液が変色するまでに12.2mLを要した。このことから、最初の結晶中のNaOHおよびNa2CO3の質量(g)を求めよ。(式量は、NaOH=40,Na2CO3=106とする)
出典:新研究p270
解説動画!
最後に
NaOHとNa2CO3の混合溶液の滴定ですが、重要なのは、やはり滴定曲線を自分で書いて量関係を求められる力をやしなうことと思います。正直それが出来たら、別にこんなものパターン化しなくても解けますからね。
それでは、本番の健闘を祈る!













コメントを残す