こんにちは。
最近色々な参考書を読みあさっています。
やっぱり、もっといい表現がないか?
もっといい記事にならないか?
と日々研究しています。
このサイトだけで受験化学を完成させられる、そんなサイトにどんどん進化させていこうと思っています!
そして、色々な参考書を読んでいると、「これはもっとちゃんと書いておいた方がいいのにな〜」と思う事があるわけです。
また、
「もっといっぱいパターンあるのに、ちゃんと全部書けよ〜」って思ったりする事もしょっちゅうです。
そして、以外とあまり書かれていないのが、『熱分解』だったりするわけです。熱が絡んで化合物が別々に分解する名前のまんまの反応なわけですが、結構色々なパターンがあるのに、全部書いていない参考書、が多いです。
なので、熱分解と言えるもを、今日全て、書き出そうと思います。
これを読めば、
てなわけで、最後まで読んでくださいな!
目次
パターン①水和物→無水塩+水
水和物というのは、よく出るので、CuSO4・5H2Oなどがあります。
こちらの記事に硫酸銅五水和物などの、水和物の濃度計算方法が書かれています。
加熱される事で、弱い結合の水和水が切れてバラバラになります。これには2パターンあります。
そして、この水和物の熱分解は、普通に加熱によって起るものと、風解という現象があります。風解とは、水和物を放置していると、自然に水和水の一部が失われる現象です。
加熱のみ
塩化カルシウム六水和物などがあります。
CaCl2・6H2O→CaCl2+6H2O
風解した後に加熱するもの
まず風解します。
Na2CO3・10H2O→Na2CO3・H2O+9H2O
結晶水を失って粉末になります。
そして、加熱します。
Na2CO3・H2O→Na2CO3+H2O
このようにして、風解したあとに、
加熱して熱分解するパターンがあります。
この反応以外にも、
CuSO4・5H2O→CuSO4・3H2O+2H2O
の風解反応が起こり、
これを加熱する事で、
CuSO4・3H2O→CuSO4・H2O+2H2O
となります。
さらに加熱する事で、
CuSO4・H2O→CuSO4+H2O
となります。
これが
1つ目のパターン水和物→無水塩+水
です。
水酸化物→酸化物+水
イオン化傾向Mg~Cu2+の水酸化物は加熱すると酸化物と水に変化します!
一般化するとこういう反応です。
2OH–→(加熱)H2O+O2-
この反応は、イオン化傾向Mg~Cu2+の水酸化物におこります。
Cuよりイオン化傾向が小さい、HgやAgは、常温で水酸化物が酸化物と水に変わります。
この一般式に当てはめると簡単に
反応式が書けます。
ステップ①イオン反応式を思い浮かべます。
2OH–→O2-+H2O
ステップ②金属イオンを当てはめます。
Cu(OH)2→CuO+H2O
ステップ③係数合わせ
アルミニウムなどだと係数合わせが必要になります。
2Al(OH)3→Al2O3+3H2O
パターン③酸化数の変化を伴う熱分解
NH4NO2→N2+2H2O
という反応があります。
亜硝酸アンモニウムから窒素が発生する
という窒素の生成反応です!
これは、NH4+とNO2–
で考えます。
このそれぞれの酸化数は、
NH4+は-3
NO2–は+3です。
これを酸化数直線で表すと、下のようになります。

この2つの酸化数がちょうど真ん中である0になるように熱分解します。
ちょうど0はNの分子であるN2です。これは実験室的な窒素N2の生成反応と表されます。
CaC2O4→CO+CO2+CaO
シュウ酸カルシウムを加熱すると、一酸化炭素、二酸化炭素が発生し、生石灰が生成します。
これも実は酸化数直線が関わります

化合物→単体
2Ag2O→4Ag+O2
H+イオンの移動による分解反応
NH4Cl→(加熱)NH3+HCl
これは、NH4+からCl–へH+が移動していますよね。
その他にもソルベー法でも出てくる、
2NaHCO3→(加熱)Na2CO3+CO2+H2O
もあります。
このように炭酸水素塩(HCO3–)は
2HCO3–→H2O+CO2+CO3–
という反応が起ります。
なので、カルシウムでも同じ反応が
書けます。
Ca(HCO3)2→H2O+CO2+CaCO3
と言う風な反応式が書けます!
パターン⑥脱炭素反応いよる熱分解
これは分子からCO32-が抜けて行く、
熱分解反応なんですよ。
酢酸カルシウムの熱分解反応です。
これは、入試では、
酢酸カルシウムの乾留と言う名前で
出てきます。
(CH3COO)2Ca→(加熱)CaCO3+CH3COCH3
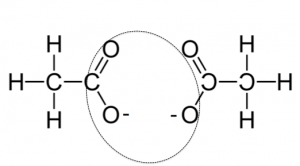
この点線に囲まれている部分が
脱離して、炭酸イオンになります。
そしておまけでアセトンも出来ます。
パターン⑦濃硫酸+加熱による脱水反応による熱分解
HCOOH→CO+H2O (→COの実験室的製法です)
C2H5OH→C2H4+H2O(C2H4の実験室的製法)
その他①二酸化炭素の工業的製法
CaCO3→CaO+CO2
炭酸塩の反応は、熱分解では、
CO32-→CO2+O2-
です。
両辺にCa2+を加えると、
CaCO3→CO2+CaO
と完成します!
その他②O2の実験室的製法
2KClO3→2KCl+3O2→O2の実験室的製法
様々な熱分解反応がありましたが、
受験で出る熱分解を全て出したんじゃないか?
と思います。
キッチリ復習すれば熱分解は余裕です。
















Nの酸化数は、
アンモニウムイオンのとき、-3
硝酸イオンのとき、+5
だと思ってました∑(゚Д゚)
ごめんなさい!
NH4NO3
ってかいてたけど、
NH4NO2でした!
だからNO3–は
酸化数+5であってます!
ありがとうございます!
素晴らしい解説です。頭がすっきりしました。
なかむら先生のお書きになった炭酸水素イオンの熱分解の化学式で、
最初に係数の2が落ちている気がします。
抜けてました!
ご指摘ありがとうございます!
修正しました!
炭酸水素塩(HCO3-)は
2HCO3 -=H2O+CO2+CO3 – の反応
炭酸塩(CO3-)は
CO3 2-=CO2+O 2- の反応ですね!
スッキリしました
おお、ありがとうございます!
酸化数の変化を伴う熱分解について質問させてください。
ここでは反応後の酸化数が等しくなっていますが、
一般に酸化還元反応は酸化数の差がなくなるような変化をするのでしょうか?
アセトンの乾留ではなく、酢酸カルシウムの乾留によるアセトンの製法ですよね。
亜硝酸アンモニウムの熱分解とシュウ酸カルシウムの熱分解は酸化数の変化を伴ってるんですよね?
ってことは、いわゆる自己酸化還元反応って解釈で合ってますか??
NH4+ が酸化数 -3で、NO2-が酸化数+3ではないですか?
ありがとうございます。