こんにちは。
入試で出てくるフェノールの製法は3つあります。
・クメン法
がありますが、これとは別にもう1つあります。
それが『ベンゼンスルホン酸』を経由してフェノールを作る方法です。
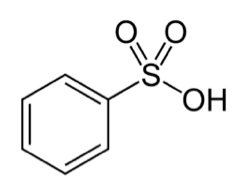
クロロベンゼンを経由してフェノールを生成する方法とかなり似ています。
なぜ、フェノールを生成するために、ベンゼンスルホン酸を経由するのか?
に着目してこの記事を読んでいってください。
目次
ベンゼンスルホン酸を経由するフェノールの製法の流れ
ベンゼン→ベンゼンスルホン酸
まずベンゼンからベンゼンスルホン酸にします。

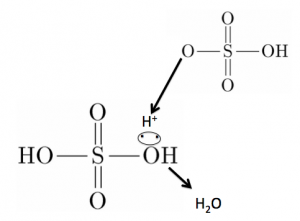
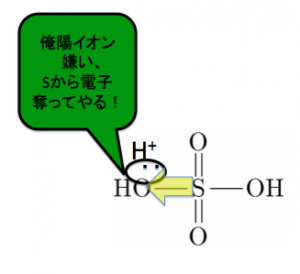
まず濃硫酸が水素イオンをぶつけて、SO3H+の陽イオンを作ります。
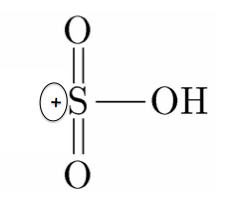
これがベンゼンのC-H間の共有電子対を攻撃します。
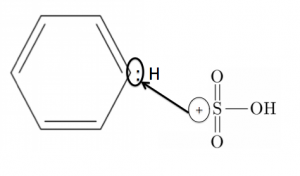
そして、H+を吹き飛ばします。

そして、硫酸イオンは元の硫酸に戻るので触媒でしたね。
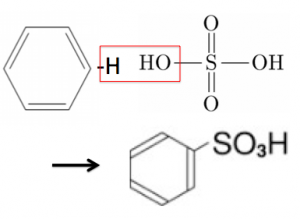
ということで、このように脱水縮合とも考えてよかったのです。
ベンゼンスルホン酸→ベンゼンスルホン酸ナトリウム
まず、ベンゼンスルホン酸をベンゼンスルホン酸ナトリウムに変換します。
ベンゼンスルホン酸は強酸ですので、強塩基の水酸化ナトリウムと中和反応させます。
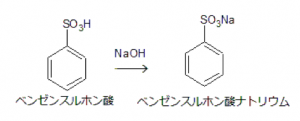
このように中和させます。
なぜベンゼンスルホン酸を中和させてイオン化させるのかというと、ベンゼンスルホン酸ナトリウムのイオンになると、沸点が高くて揮発しません。
なので、クロロベンゼンのときのように、高圧にする必要がありません。
ベンゼンスルホン酸ナトリウム→ナトリウムフェノキシド
ここが、ベンゼンスルホン酸からフェノールを生成させる方法が 『アルカリ融解法』と言われる理由です。
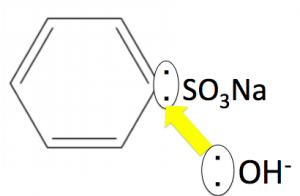
SO3は陰イオンが安定するため、またCより、Sの方が電気陰性度が大きいため、C-S間の共有電子対を引きちぎって取れてくれます。
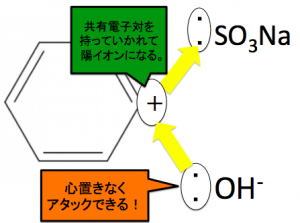
このように陽イオンになる事で、ベンゼン環のCが陽イオンになります。
このように、ベンゼン環は炭素を陽イオンにしないと、OH–がアタックできません。
なぜなら、
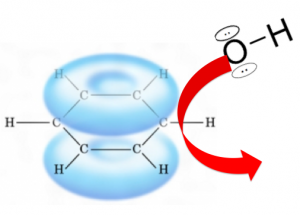
ベンゼン環は安定な電子の雲に囲まれているため、全体的に−を帯びています。
だから陰イオンで電荷が−の水酸化物イオンOH–なんかは、近づけないわけです。
このことから、まず別の陽イオン(SO3H)にアタックさせます。
で、こいつがベンゼンから電子を引きちぎって、陽イオンにしてもらってからOH–でアタックするのです。
ただ、やはりベンゼンスルホン酸のSO3Hが抜ける反応と言うのは、自然な反応ではないので無理やり起こします。
スゴい数と勢いで、OH-にベンゼンスルホン酸をアタックさせるのです。そのために、NaOHを超高濃度にします。
この世で最強の高濃度というのは、『固体』です。

このベンゼンスルホン酸からフェノールを経由する方法をアルカリ融解法と言いますが、融解とは『固体から液体になる事』でした。
そう、水酸化ナトリウムの固体を液体にしてそれでベンゼンスルホン酸にアタックしまくります。
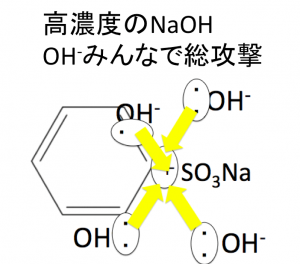
このように高濃度にすると、たくさんで攻撃できるので、SO3NaがとれてOHがくっつきやすいのです。
で、OHがくっつきますが、周りがNaOHだらけですのですぐ中和されてナトリウムフェノキシドになります。
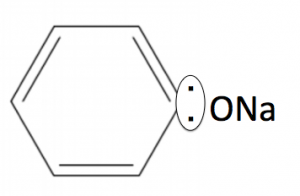
このようになります。
ナトリウムフェノキシド→フェノール
ナトリウムフェノキシドからフェノールを取り出すのは、簡単です。
『弱酸遊離反応』です。
ここからは、クロロベンゼンを経由してフェノールを作り出す方法と全く同じです。
これを利用してフェノールが出来るわけです。
注意点
クロロベンゼンを経由してフェノールを作り出すときは、高圧条件が必要でした。
ですが、ベンゼンスルホン酸経由してフェノールを作るときは高圧条件は不要です。
なぜなら、ベンゼンスルホン酸ナトリウムは非常に沸点が高くて、揮発しません。なので、クロロベンゼンのときにひつようだった、

こういう圧力をかける必要は無くなります。
どうですか?
このようにベンゼンスルホン酸を経由する理由は、ベンゼン環の安定性なんですね。
これをキッチリ意識すると非常に楽に覚えられます。














クロロベンゼンの時のように高温のNaOH水溶液を使用してベンゼンスルホン酸をナトリウムフェノキシドにすることはできますか?
はい。できないです。個体の水酸化ナトリウムを使いましょう
めちゃくちゃわかりやすいです!
いままで覚えは忘れを繰り返してたのがあほらしくなりました笑
ベンゼンスルホン酸のまま水酸化ナトリウムと反応させることはできないんでしょうか。その場合だと揮発してしまうから、高圧条件にしなくてはいけないですか。
わかりやすっ!
わっっっっっっっかりやすっ!
ありがとうございます!!!
分かりやすすぎます!(;Д;)(;Д;)
反応式を眺めてただ丸暗記のではなく、しっかりと理屈を理解して覚えることが出来ました!
本当に感謝しかありません!ありがとうございます!
CよりSの方が電気陰性度が大きいのでって書いてますが、小数第一位まで書いてある表だと同じ値になってます‥0.1未満の差でも原子レベルでは共有電子対を持って行かれるほどの大きな差なのでしょうか?
確かに、書き方がよくなかったです。
SだけでなくSO42-で考えてみると、Oに電子を奪われているSは電子を欲しています。
CとSを単純に比較するとほぼ同じですが、SO42-となると、話は別になります。
主語がどれをさしているのか分かりづらい文章ですね
確かに、修正します