こんにちは。


高校化学に出てくる「工業的製法」の中でも、受験によく出るのが「ソルベー法」です。
その名前を聞いただけで身構えてしまう人もいますが、実はソルベー法の反応自体はそれほど難しくありません!
この記事ではソルベー法の各ステップの反応を、分かりやすい模式図も用いて徹底解説します。
さらにゴロ合わせも活用し、その反応式をカンペキに覚えちゃいましょう!
目次
ソルベー法の目的
ソルベー法(アンモニアソーダ法)を発明したベルギー人科学者アーネスト・ソルベーには、野望がありました。

それはガラスの材料になる炭酸ソーダ(Na2CO3)を安く大量に作りたいというもの。
そこで目をつけたのは食塩(NaCl)と石灰石(CaCO3)でした。
だって食塩=塩化ナトリウム(NaCl)なんて、海から無限と言っても良いほど取れます。

そして石灰石=炭酸カルシウム(CaCO3)も天然に腐る程あります。

これから板ガラスやガラス瓶の材料である炭酸ナトリウム(Na2CO3)を作れたら、ボロ儲けじゃないですか!

そして考えられたのがアンモニアを使って炭酸ソーダを作り出すというアンモニアソーダ法。彼の名前をとってソルベー法とも呼ばれます。
複雑な反応に見えるソルベー法ですが、主な反応は2つだけでそれ以外の反応は材料集めにすぎません!
では詳しく見ていきましょう!
炭酸ナトリウムの性質についてもっと詳しく知りたい人は、この記事も読んでみてください。
ソルベー法の流れと手順
Step1 食塩水にアンモニアを溶かす
まず食塩水(NaCl水溶液)にアンモニア(NH3)を溶かします。

これはただ溶かすだけなので、化学反応ではありません。
Step2 石灰石を熱し二酸化炭素を発生させる
石灰炉と呼ばれる設備で石灰石=炭酸カルシウム(CaCO3)を熱し、二酸化炭素を発生させます。

CaCO3 → CaO + CO2
また副産物として酸化カルシウム(CaO)が生じます。
Step3 炭酸水素ナトリウムを発生させる
さあ、いよいよ最も重要な反応です!
Step1で作った食塩&アンモニア水溶液に、Step2で作った二酸化炭素を吹き込みます。
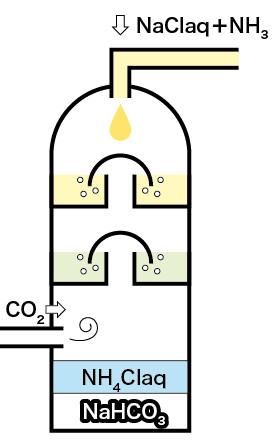
この反応を行うソルベー塔(別名・反応塔)は上の図のような構造になっています。
上部から注入された食塩&アンモニア水溶液と下から吹き込んだ二酸化炭素が連続的に反応できるようになっているんですね。
ここでは下のような化学反応が起きます。
NaCl + H2O + NH3 + CO2 → NaHCO3 + NH4Cl
炭酸水素ナトリウムが沈澱し、塩化アンモニウム水溶液が上澄みとして残るのです。
この反応式が先ほど述べた「主な反応」の一つ目です。
超重要ですのでしっかり覚えましょう!
化合物の並ぶ順番が少し違いますが、下のゴロが有効です。
兄さん加担、ナックルで見ずに安心、ナフコさんも安心
兄さん加担(二酸化炭素)、ナックル(NaCl)で見ず(水)に安心(アンモニア)、ナフコさん(NaHCO3)も安心(塩化アンモニウム)
CO2 + NaCl + H2O + NH3 → NaHCO3 + NH4Cl

草野球で自分のチームに兄さんが加担してくれました。兄さんはナックルを投げるため、全く打たれません。守備には飛んでこないので見ずに安心できます。観戦にきていたナフコさんも安心しています。
というイメージです。
Step4 炭酸水素ナトリウムの熱分解
炭酸水素塩を熱すると 2HCO3– → H2O + CO2 + CO32- の反応が起きます。
したがって、Step3で生成した炭酸水素ナトリウムを熱すると
2NaHCO3 → Na2CO3 + H2O + CO2
と反応し、目標物質の炭酸ナトリウム(Na2CO3)が生成します。
ちなみに、これが「主な反応」の2つ目です。
先ほど二酸化炭素を加えて炭酸水素ナトリウムを沈澱させたけど、ここでまた二酸化炭素が発生していますね!
実はStep3で反応させた二酸化炭素のうち、半分はここで再びガスになって出てきてしまいます。
しかしそこは抜かりのないソルベーさん。この二酸化炭素も、Step3の反応に再利用されます。
熱分解についてもっと詳しく知りたい人は、この記事も読んでみてくださいね。
さあ!これで全部の反応が終わり… と思ったあなたはちょっと気が早い!
ほら、何か忘れていませんか?
ソルベー法に用いる原料は「食塩」と「石灰石」だけのはずなのに…
Step1のアンモニアはどこから来たのでしょう!?
実はこのアンモニア、設備の中をグルグル循環しているんです!
Step5 アンモニアの再利用
Step1で食塩水に溶かしたアンモニアガスは、Step3で塩化アンモニウム水溶液になりました。
この塩化アンモニウムから再びアンモニアガスを取り出せれば… アンモニアを作ったり買ったりしなくていいので、ものすごい経済的ですよね!
そこでソルベーさんが目をつけたのは、Step2の副産物である酸化カルシウム(CaO)。
酸化カルシウムを水に入れると、強塩基性の水酸化カルシウム(Ca(OH)2)が生じます。
CaO + H2O → Ca(OH)2
この水酸化カルシウムを、Step3で上澄みとして残った塩化アンモニウム水溶液に入れると…
弱塩基遊離反応によって、アンモニアが発生するのです!
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
捨てるしかないと思われた副産物の「酸化カルシウム」と「塩化アンモニウム」から、反応に必要なアンモニアを再生するなんて…
ソルベーさん、天才です!
ちなみに最後の反応の副産物である塩化カルシウム(CaCl2)ですが…
これも乾燥剤や融雪剤として活用します。

そうです!ソルベー法は全くムダの出ない、夢のような工業製法なのです!
ソルベー法のまとめ式
Step1からStep5をまとめると、下のようになります。
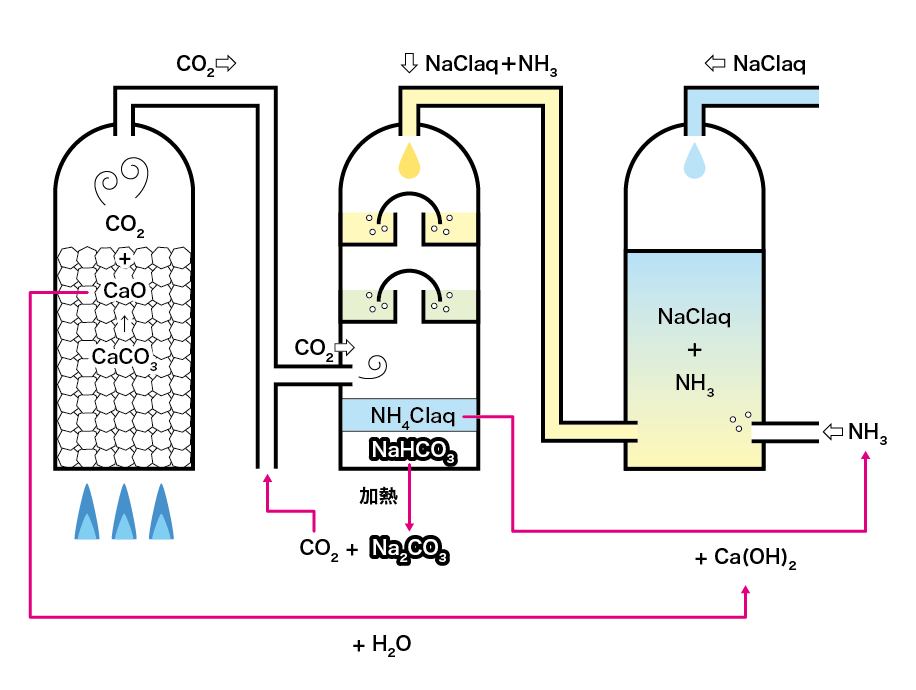
全体の反応式は
2NaCl + CaCO3 → Na2CO3 + CaCl2
となり、「食塩と石灰石から炭酸ナトリウムと塩化カルシウムを作る」という超シンプルなものにまとめることができます!
ソルベー法のFAQ
ソルベー法について、よく聞かれる質問に答えていきます!
いきなり反応できないの?

残念ながら食塩と石灰岩を混ぜても反応しません!
それは 2NaCl + CaCO3 → Na2CO3 + CaCl2 の反応より Na2CO3 + CaCl2 → 2NaCl + CaCO3 の反応の方が起こりやすいから。つまり
逆反応の方が起りやすいのです。
そのままでは一向に反応が進まないので、回りくどくNaHCO3を経由しているんですね。
アンモニアって必要?溶かしておく理由

アンモニアを溶かす理由は、CO2を溶かしやすくするためです。
CO2は水に溶けますが、溶解度が大きいわけではありません。
そこで溶液をアンモニアで塩基性にする事で、中和反応を起こし塩を生成させるために入れておくのです。
なぜHCO3–で終わりなのか?

NaHCO3は溶解度が非常に小さいです。
なので、中和反応で HCO3– が CO32- になる前にNaHCO3の形で沈殿してしまうのです。
まとめ
ソルベー法のポイントは、水に溶けにくい二酸化炭素ガスをアンモニアとの「中和反応」という形で大量に反応させること。
さらにそのアンモニアは二酸化炭素発生の副産物から作った水酸化カルシウムとの弱塩基遊離反応によって、再び取り出してくり返し利用できます。
ソルベー法の反応の流れは下の通りです。
- アンモニアを食塩水に溶かす
- 石灰石を熱して二酸化炭素を発生させる
- 1と2を反応させ、炭酸水素ナトリウムを発生させる
- 炭酸水素ナトリウムを熱分解し、炭酸ナトリウムを発生させる
- 弱塩基遊離反応により、アンモニアを再利用する
全体としての反応式は
2NaCl + CaCO3 → Na2CO3 + CaCl2
です。
実はアメリカで炭酸水素ナトリウムの巨大鉱床が見つかったことや電解法で生成した水酸化ナトリウムを二酸化炭素で中和する方法が開発されたことから、現在ソルベー法はソーダ工業の主流ではなくなっています。
しかし高校化学・大学受験の世界ではいまだに花形の反応!
カンペキになるまで、キッチリ復習しておきましょう!
ソルベー法のように工業的に大量に化合物を生成する「工業的製法」は大学受験でもよく出題されます。工業的製法のみをまとめた記事を作成しましたので、以下の記事をご覧ください。
またソルベー法以外にもアルカリ金属には出題される題材が多数あります。
- 水酸化ナトリウムの工業的製法「融解塩電解」
- 水酸化ナトリウムの性質「潮解性」
- 炭酸ナトリウムの性質「風解」
- 炭酸ナトリウムの製法
これらのアルカリ金属に関して大学受験で出題されるものを全てまとめた記事を作成しました。アルカリ金属を完全にマスターしたい方は以下の記事をご覧ください。

















無機化学の工業的製法を全て網羅していただけるとありがたいです。
そうですね。
実現できるよう頑張ります。
ソルベー法のまとめ式はどのようにして出てきたのでしょうか
まとめ式は、連立方程式を解くのですが、俺は、ソルベー法は安いものから良いものをつくろうと考えた方が簡単に作れるので、連立方程式を解くだけを載せるまでもないと思い、載せていません。
今まで教科書のソルベー法を見て、なんじゃこのわけ分からん表は…。嫌い!! と偏見を持っていましたが、この記事を読んで感動しました!
理由を知って学んでいけば、こんなに簡単に頭に入るんですね!
ソルベー法ちゃんと理解すると、ソルベーが天才である事がわかって楽しいですよね〜
感動していただきありがとうございます。
語呂合わせと炭酸水素塩の熱分解と炭酸塩の熱分解をキッチリさせるだけでかなり頭のが整理できました。
どれもよく見ると単純なんですね笑
そうなんですよね〜
ソルベー法は式も5つあるからうっとなるんですけど、
流れを知ったら絶対に出来ます!
こんにちは。
化学はよく分からないのですが文章がおもしろくて、読んでいます。
基本的な質問ですみません。
ソルベー法②のところに
2HCO3-→H2O+CO2+CO3-という式がありますがCO3-って、何というイオンでしょうか?
CO32- とは違うものですか?
ありがとうございます。
ご指摘ありがとうございます。CO32-でしたね。
すみません、素人が余計なことをいいました。
ありがとうございました。
また化学の勉強つづけます。
いえ、ありがとうございます。
すきです
ありがとう!
アンモニアを水に溶かして塩基性にしてから二酸化炭素を吸収させることで、単なる溶解ではなく中和反応に持っていき完全に溶かすわけですか…
気体の中和(逆滴定)のときと同じことやってますね
そうですね!
まあここでは100%溶かす必要も無いのですがね。
こんにちは。
初めの反応で、塩化ナトリウムという強酸強塩基の塩に弱塩基や弱酸を入れても反応しないんじゃないかなと思ったのですが、炭酸水素ナトリウムが沈殿する反応の反応機構はどうなってるんでしょうか?
なるほど。
これに関してはアンモニアが単純に水に溶けやすいというだけです。
NaClとNH3が反応しているわけではありません。
二酸化炭素を下から吹き込むのって何か意味があるんですか?
下からの方が溶液と接する時間が長く反応しやすいです。