化学基礎で最初に学ぶ化学の基本中の基本これが、イオン式ですよね。ですが、イオン式の価数だったり、一体何を覚えたらいいのか、どれが規則的に求められるのか疑問に思うこともあるでしょう。
なので、今日は、このイオン式では何を覚えればいいのか、何を覚えなくていいのかを徹底的にまとめていきます。
目次
イオン式とは?
イオン式とは、もうそのまんまですが、イオンを表す式です。
イオンは、原子や分子と違って電気的に正か負に偏りがあります。
原子や分子のように、電気的に中性(±0)のものもあります。
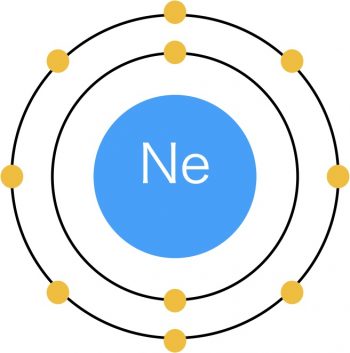
このようなネオンは、陽子の電荷が+10で、電荷-1の電子が10個あるので打ち消しあって電気的に中性です。
同じように分子も分子全体だと電気的に中性になります。

こういう原子や分子と違って、イオンは、電気的に偏りがあります。例えば、Naは、Na+の方が閉殻構造になって安定して存在しやすいです。

ナトリウム原子は、このような電子配置ですが、この電子配置から電子が1個抜ければ、陽イオンになります。すると、

こちらの方が安定な構造になります。すると、このナトリウム全体で考えた場合は、電荷は+1となります。
 陽子が+11で電子が-10ですからね。このような+1の電荷の偏りを表すには、Naのような元素記号では表せなくなります。このような電荷の偏りごと表すために、イオン式というものを用います。
陽子が+11で電子が-10ですからね。このような+1の電荷の偏りを表すには、Naのような元素記号では表せなくなります。このような電荷の偏りごと表すために、イオン式というものを用います。
閉殻構造に関する記事(未完成)
陽イオンや陰イオンを表す式のことをイオン式と言います。

イオンの名前の付け方
単原子の陽イオン
元素名の後に「イオン」をつけるだけでよし!
例:H+ 水素イオン Na+ ナトリウムイオン K+ カリウムイオン
単原子の陰イオン
元素名の語尾に「化物イオン」をつける。原子ごとに覚えるべきこともある。
Cl–は、塩素の「素」を抜いて「化物イオン」をつけて塩化物イオン、S2-は硫黄の「黄」を抜いて「化物イオン」をつけて硫化物イオンと読む。
また、2原子イオンのOH–やCN–だけは、抜かずに「水酸化物イオン」「シアン化物イオン」と読む。
多原子の陽イオン
固有の名前で呼ばれることが多いので、暗記する必要がある。
| イオン式 | 読み方 |
| NH4+ | アンモニウムイオン |
| H3O+ | オキソニウムイオン |
| C6H5NH3+ | アニリニウムイオン |
陽イオンは多くの場合〜iumイオンという名前になる。
アンモニウム(Ammonium)
オキソニウム(Oxonium)
アニリニウム(Anilinium)
アルミニウム(aluminium)
カルシウム(calcium)
多原子の陰イオン
酸性物質からH+が取れたものが多く「〜酸イオン」と呼ばれる。
例:NO3–(硝酸イオン)SO42-(硫酸イオン)PO43-(リン酸イオン)CO32-(炭酸イオン)CH3COO–(酢酸イオン)、HCO3–(炭酸水素イオン)
イオン式の一覧
イオン式は、まず単原子イオンの場合は、典型元素は規則性があります。1族は電子を1つ投げたら閉殻構造になりますので +1、2族は+2、逆に17族は電子(-1の電荷)を1つ得れば閉殻構造なので、-1と決まっております。
しかし、それ以外の遷移元素は、暗記しましょう。大学に行くと電子軌道を習うことで、ちょっとだけわかりますが、全て規則に従うわけではないので、大学で科学を習ったとしてもイオン価数は覚えるしかありません。
ってなわけで一覧を示しておきます。
| 陽イオン | イオン式 | 価数 |
| 水素イオン | H+ | 1 |
| ナトリウムイオン | Na+ | |
| カリウムイオン | K+ | |
| 銅(I)イオン | Cu+ | |
| アンモニウムイオン | NH4+ | |
| マグネシウムイオン | Mg2+ | 2 |
| カルシウムイオン | Ca2+ | |
| 銅(II)イオン | Cu2+ | |
| アルミニウムイオン | Al3+ | 3 |
| 陰イオン | イオン式 | 価数 |
| フッ化物イオン | F– | 1 |
| 塩化物イオン | Cl– | |
| ヨウ化物イオン | I– | |
| 水酸化物イオン | OH– | |
| 硝酸イオン | NO3– | |
| 硫化物イオン | S2- | 2 |
| 硫酸イオン | SO42- | |
| 炭酸イオン | CO32- | |
| リン酸イオン | PO43- | 3 |
まとめ
- イオン式は、元素記号だけでは表せない電荷の偏り+か-を表した化学式
- 典型元素はイオンのなりかたに規則があり、遷移元素は覚えるしかない
- 読み方は単原子イオンは規則があり、多原子イオンは個別に覚える必要がある
- 陽イオンは〜iumという名前になることが多い。
- 補足だが、陰イオンは〜ideとなることが多い。
今日の記事はいかがでしたか?最後までご覧いただきありがとうございます!