こんにちは。
炭化水素の分類として、アルカン、アルケン、アルキンがあります。
このうち、本日は、アルケンについて、お話しします。
alkeneは置換命名法で、
alk(炭素数)
e(二重結合あり)
e(構成元素C,Hのみ)
なので、二重結合があります。
この二重結合の反応性は、以前お話ししました。

二重結合の二本目
のπ結合がゆるゆるだから、
非常に反応性が良いのでした。
なので、特に
強い反応試薬を使う事無く、
π結合を切る事が出来ます。
それによって起る反応が、
『付加反応』です。
また付加でも、
H2やX2(ハロゲン)
が付加するパターンと、
HX(水素化物)が付加するパターンで、
考えるべき事も変わります。
結合の仕方も変わりますので、
徹底的に学んで行きましょう!
[quads id=6]
目次
付加とは?
付加反応とは読んで字のごとく、
付け加わる反応です。

このようなアルケンに、
H2やCl2、Br2等が付け加わるのです。
そして、水素付加、ハロゲン付加、
水素化物付加でそれぞれ、
反応や触媒が微妙に異なります。
なので、それぞれ学んで行きましょう!
水素H2付加
水素付加の反応は、
『ラジカル反応』です。
水素がラジカルになって、
アルケンを攻撃して、
π結合をぶった切ります!
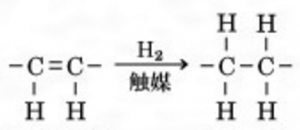
二重結合に水素がくっついて、
アルケンがアルカンになります。
このアルケンに対してアタックする、
水素が『ラジカル』なんです。
水素のラジカルが、
アルケンを攻撃します。
しかし、普通にしていたら、
水素ラジカルはできないので、
このように、
水素ラジカルをくっつけておく
のが得意な、ニッケルや白金
を触媒として、

このようにくっつけておくのです。
そして、アルケンが常温常圧で、
このニッケル、白金に
ぶつかりにいき、
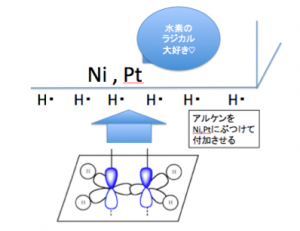
このπ結合のぺたぺた水素を
くっつけるのです。

そして受験的には、
このように見なして覚えても良いのでした!
ちなみに、水素付加は、
ベンゼン環でも起りますが、
ベンゼン環の場合は、
高圧条件です。
ベンゼン環は、
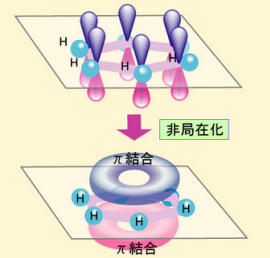
このようにπ結合が、
非局在化し、共鳴と言う現象が
おこっているので、アルケンより
結合が切りにくいのです。
ちなみに、この付加反応で、
ラジカル反応を使うのは、
かなり特殊です。
ハロゲン付加
水素付加はラジカル反応
でしたが、
それ以外は、
①陽イオンがアタックする
②片方にくっつき、片方が+に偏る
③陰イオンが+にぶつかって行く
と言う、反応を起こして行きます。
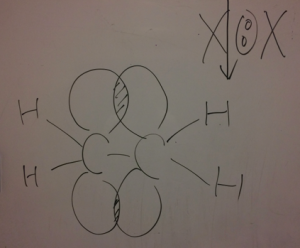



このような流れで反応します。
水素化物付加
水素化物と言うのは、
HーXが付加することです。
水や塩化水素などです。
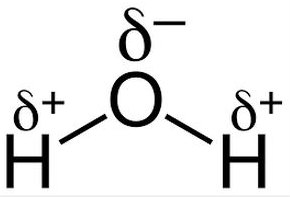

このような物です。
これがアルケンに付加するときは、
先ほどのハロゲンと同じように、
陽イオンが先に二重結合の
π結合にアタックします!
(この陽イオンはH+)
そして、その後に、
残りの陰イオンがアタックして行きます。
ちなみに、この水素化物の
付加ですが、
『アルキンは水銀触媒が必要です』
『アルケンは不要です。』
実際に京都大学や、
静岡薬科大学でこの水銀触媒で、
「あ、これはアルキンだ!」って
気付こうね〜って問題が出ています。
マルコフニコフ則
非対称アルケン、
例えば、

プロペンなどがありますが、
プロペンにH2Oが付加するとき、
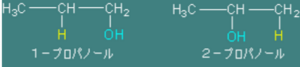
出来るプロパノールは上の
2種類があります。
1-プロパノールと2-プロパノール。
では、これは半分半分できるのか?
というと、そういうわけではないのです。
実は、これは、
2-プロパノールが主生成物なのです。
この法則は、簡単で、
付加するもの、
H-ClのうちHが付加する炭素は、
Hが多くついている方!
と言う法則があります。
Hな奴はHな奴が集まっている方に、
くっつくのです。
これは中学校とかでも一緒です。
エロい奴はエロい奴と群れます。

HはHなやつと群れる!
と覚えましょう!
付加重合
π結合を持ったものが、
自分と同じ奴と、
ぺたぺた結合していったものが、
付加重合です。

この画像のように、
π結合の電子が
隣のπ結合の電子と
結合するイメージです。
付加重合というのは、
完全にラジカル反応です。
付加重合と言うのは、
下のように起ります。
少量の開始剤が必要
開始剤と言うのは、
付加重合を始めるための物です。
このように、
アルケンをラジカルにする必要が、
あります。
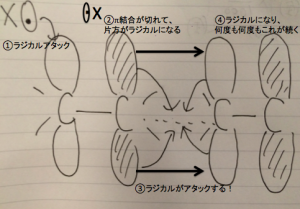
①アルケンの1番端と開始剤が
結合する事により、
π結合をしていた片方の
π電子がラジカルになります。
②ラジカルになった場合、別の
π結合をめがけて攻撃を仕掛けます!
③このようにどんどん繋がって行って、
高分子になります。
エチレンが繋がりまくると、
このようにエチレンのπ結合が、
周りのエチレンとくっつくのに、
使われて下のようになります。
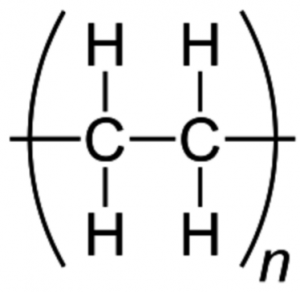
これをポリエチレンと言います。
ポリ=いっぱいと言う意味です。
このポリエチレンのことを
『ポリマー』といい、
なんこもなんこも繰り返されるパターン
である、エチレンのことを、
『モノマー』と言います。
酸化開裂とは?
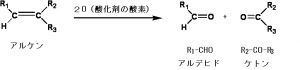
酸化開裂とは、
アルケンの二重結合をぶった切る反応です。
>C=C<を切って、
>C=O O=C<にします。
構造決定では、
>C=OとO=C<を
向かい合わせろ!そこに、
二重結合あり!!!
このように使ってください、
そして、O3を用いた場合、
KMnO4を用いた場合では、
反応結果が異なるので、
それにも注意しましょう!
また、
①オゾン開裂O3

オゾン開裂は、
酸化開裂後には、ケトン、もしくはアルデヒド
が生成する。
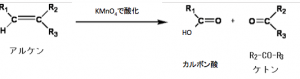
②KMnO4で酸化開裂
酸性条件(激しい条件)で酸化開裂
O3似よる酸化開裂反応で
アルデヒドが生じるアルケンは、
KMnO4により激しく酸化すると、
アルデヒドがさらに酸化され
カルボン酸になる。
中性塩基性条件(穏やかな条件)で酸化
アルケンを酸化開裂することはできず、
ジオールが生成する。
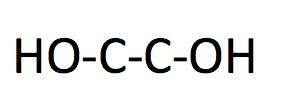
このように、
開裂の仕方や条件によって
生成物が変わります。
石油化学工業
アルカンのときに、
ナフサの熱分解が
石油化学工業になる。
と言っていましたが、

このようにナフサを熱分解すると、
アルケンである、プロペンとエチレンが
出来ます!
以上がアルケンの主な反応です。
結合の切断と再生と
考えると、
かなり反応の構造がわかりやすくなります。















ベンゼンの付加反応の記事で塩素付加はベンゼンもアルケンも光や熱条件下でラジカルにしてアタックさせるとあったのですが、こちらのハロゲン付加では陽イオン、陰イオンに分かれてから付加しているのはなぜですか?
それはベンゼン環の安定性の問題です。
ベンゼン環に付加するときは、
『同時に、一気に大量に』と言うのが
重要です。
ベンゼン環の共鳴状態についての記事です
ですが、アルケンのπ結合はσ結合をきるより遥かに楽なのです。
なので付加反応は起りやすいのです。
聞きたいことはそういうことではなく、ベンゼン環の付加反応の記事の中で
アルケンであろうと、ベンゼンであろうと、光(紫外線)や熱条件下でラジカルになりベンゼン環にアタックしていきます。
と、あったのですが、この文章だとアルケンへの塩素付加はラジカル反応ですが、今回のアルケンへの付加反応の説明の中では、アルケンへのハロゲン付加は陽イオンのアタックとありました。
つまり、アルケンへの付加反応はラジカルがアタックすることも陽イオンになってからアタックすることもあるということでしょうか?
有機の知識がゼロ状態の私でも理解できました。このブログに出会えて自分は幸運だなあと思うと同時に、わかりやすいブログを作ってくださってありがとうございます(^o^)
ありがとうございます!励みになります!
水のアルケンへの付加が触媒無しで起こるように記載されているのは不味いのでは。酸触媒が必要です。
H-X(X=ハロゲン)の場合と混同しかねません。
確かにそうですね。
ありがとうございます。